physikalische/chemische Daten
Physikalische/chemische Daten
Im Register physikalische/chemische Daten des Detailfensters werden für das ausgewählte Produkt die wichtigsten physikalischen und chemischen und Daten angezeigt (DIN-Einheiten).
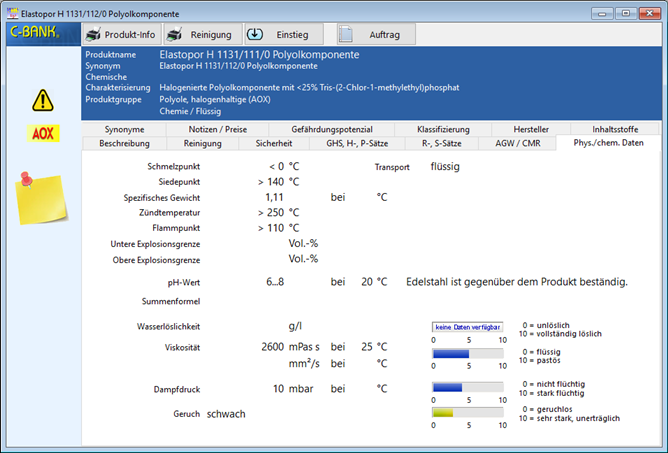
Schmelzpunkt (°C): Temperatur, bei der ein fester Stoff zum flüssigen Aggregatzustand wechselt.
Siedepunkt (°C): Gibt die Temperatur an, bei der ein flüssiger Stoff zum gasförmigen Aggregatzustand wechselt.
spez. Gewicht (g/cm³): Dieser Wert gibt an wie viel ein definiertes Volumen eines bestimmten Stoffes wiegt. Angaben in g/cm³ oder in kg/l oder in t/m³.
Dampfdruck (mbar): Dieser Druck ist bezogen auf den Dampf eines Stoffes, der mit seinem Bodenkörper (füssige oder feste Phase) im Gleichgewicht ist und dieser auf einen geschlossenen Behälter ausübt. Der Dampfdruck eines Stoffes ist nur von der Temperatur abhängig.
Flammpunkt (°C): Der Flammpunkt gibt die Temperatur einer Flüssigkeit an, bei der sich bei Normaldruck so viel Dämpfe entwickeln, dass ein durch Fremdentzündung entflammbares Gemisch entsteht (bei der Zündtemperatur kann die Selbstentzündung durch den Stoff erfolgen).
Zündtemperatur (°C): Die Zündtemperatur (auch Zündpunkt, Selbstentzündungstemperatur, Entzündungstemperatur oder Entzündungspunkt) ist diejenige Temperatur, auf die man einen Stoff oder eine Kontaktoberfläche erhitzen muss, damit sich eine brennbare Substanz (Feststoff, Flüssigkeit, deren Dämpfe oder Gas) in Gegenwart von Luft ausschließlich aufgrund seiner Temperatur – also ohne Zündquelle wie einen Zündfunken – selbst entzündet.
Explosionsgrenze: Gemische aus brennbaren Gasen, Dämpfen oder Stäuben mit Luft und damit dem in ihr enthaltenen Sauerstoff sind bei bestimmten, stofftypischen Mischungsverhältnissen explosionsfähig. Diese Mischungsverhältnisse bestimmen den Explosionsbereich, der durch seine zwei Explosionsgrenzen, der oberen und der unteren Explosionsgrenze (OEG bzw. UEG), beschrieben wird:

Man bezeichnet den Bereich unterhalb der unteren Explosionsgrenze, in dem die Konzentration des brennbaren Stoffes zu gering ist, auch als zu mageres Gemisch. Der Bereich oberhalb der oberen Explosionsgrenze wird als zu fettes Gemisch bezeichnet. Hier ist die Konzentration des brennbaren Stoffes zu hoch, um zu explodieren. Ein fettes Gemisch kann durch Luftzufuhr weiter verdünnt werden und so unter die OEG gelangen und damit explosionsfähig werden. Ein mageres Gemisch kann durch Zufuhr von Brennstoff, etwa durch Verdunsten oder Brenngaszufuhr, auffetten und damit explosionsgefährliche Stoffkonzentration erreichen.
Die Explosionsgrenzen werden auch als Zündgrenzen bezeichnet, sie sind temperatur- und druckabhängig. Bei Stäuben hat zusätzlich auch die Teilchengröße und die Teilchengrößenverteilung des Feststoffs einen Einfluss auf die Explosionsgrenzen. Wenn die Konzentration des brennbaren Stoffes in der Luft innerhalb der Explosionsgrenzen liegt, wird das Gemisch als explosionsfähige Atmosphäre bezeichnet.
pH-Wert: Werden Säuren in Wasser gelöst, geben diese durch die Dissoziation Wasserstoffionen an das Wasser ab, der pH-Wert der Lösung sinkt. Werden Basen gelöst, geben diese Hydroxidionen ab, die Wasserstoffionen aus der Dissoziation des Wassers binden. Sie können auch selbst Wasserstoffionen binden, wie es für Ammoniak → Ammonium gilt. Mithin erhöhen Basen den pH-Wert. Der pH-Wert ist ein Maß der Menge an Säuren und Basen in einer Lösung. Je nach Stärke dissoziiert die Säure oder Base zu einem mehr oder weniger großen Anteil und beeinflusst somit den pH-Wert unterschiedlich stark.
In den meisten wässrigen Lösungen liegen die pH-Werte zwischen 0 (stark sauer) und 14 (stark alkalisch). Dennoch können schon in einmolaren Lösungen starker Säuren und Basen diese Grenzen um jeweils eine Einheit überschritten werden, also von −1 bis 15. Die pH-Skala wird nur begrenzt durch die Löslichkeiten von Säuren oder Basen in Wasser. Bei sehr hohen oder sehr niedrigen pH-Werten und in konzentrierten Salzlösungen sind nicht die Konzentrationen für den pH-Wert entscheidend, sondern die Aktivitäten der Ionen. Aktivitäten sind von den Ionenkonzentrationen nicht linear abhängig.
Die meisten pH-Elektroden verhalten sich im Messbereich zwischen 0 und 14 annähernd linear. Annähernd konstante Unterschiede im gemessenen Elektrodenpotential entsprechen also gleichen Unterschieden im pH-
Viskosität (mPa): Die Viskosität ist ein Maß für die Zähflüssigkeit einer Flüssigkeit. Der Kehrwert der Viskosität ist die Fluidität, ein Maß für die Fließfähigkeit einer Flüssigkeit. Je größer die Viskosität, desto dickflüssiger (weniger fließfähig) ist die Flüssigkeit; je niedriger die Viskosität, desto dünnflüssiger (fließfähiger) ist sie, kann also bei gleichen Bedingungen schneller fließen. Normalerweise wird mit dem Begriff Viskosität die Viskosität in Scherung verbunden, es ist allerdings auch möglich, die Viskosität in Dehnung zu messen, siehe dazu die Seite Dehnviskosität. Teilchen zäher Flüssigkeiten sind stärker aneinander gebunden und somit weniger beweglich; man spricht daher auch von der inneren Reibung. Sie resultiert nicht nur aus den Anziehungskräften zwischen den Teilchen der Flüssigkeit (Kohäsion). Die Viskosität von Feststoffen ist generell sehr hoch (und damit schwer bestimmbar), stattdessen werden häufig Begriffe wie Duktilität, Sprödigkeit und Plastizität verwendet. Die dynamische Viskosität der meisten Flüssigkeiten nimmt mit steigender Temperatur ab, daher ist die Angabe einer Referenztemperatur wichtig.
tendenzielle Angaben in einer Skala von 1 – 10:
Wasserlöslichkeit (g/l) Bewertet die Fähigkeit eines Stoffes mit Wasser eine echte Lösung zu bilden.
Viskosität (mPas/s) Bewertet die Zähigkeit bzw. innere Reibung eines Stoffes. Je größer der Wert der Viskosität, desto dickflüssiger ist die Flüssigkeit.
Flüchtigkeit siehe Dampfdruck